中国·上海——2024年5月7日,瑞孚迪(Revvity)与三优生物医药(上海)有限公司(以下简称“三优生物”)达成深度合作,共同推进创新生物药物领域的发展。双方签署了关于三优生物引入CHOSOURCE™蛋白表达平台中TnT转座子系统的商业授权协议。

瑞孚迪的CHOSOURCE表达平台在全球范围内被广泛应用,并且在生物制药行业中得到普遍认可。目前,已有超过65个正在研究的新药应用(IND)采用该平台,在生物制药行业里应用于生物疗法的开发和制造。
三优生物是生物技术领域的全球先行者,专业于创新生物治疗药物的研究、开发和生产服务,拥有先进的设备和高质量的解决方案。作为CHOSOURCE表达平台的长期用户,三优生物从谷氨酰胺合成酶(GS)敲除CHO K1细胞的授权开始了他们的旅程,现在通过将CHOSOURCE TnT转座子技术纳入其产品中,进一步扩大了其能力。这一补充完美地补充了Revvity CHO GS KO细胞系,可有力支持三优“超万亿、一体化、智能化”三大创新药研发技术平台,为客户提供优质的创新生物药研发和服务。
瑞孚迪技术和授权许可高级副总裁Bryan Kipp表示:“在瑞孚迪,我们的文化认同植根于挑战现状,致力于改善人类健康与生活。在支持生物生产行业方面,我们的战略旨在通过开发创新的表达平台来支持我们的合作伙伴,帮助创新药物更快、更便宜、更安全地进入市场。为此,我们很高兴三优生物通过签订CHOSOURCE TnT转座子技术的新许可协议,扩大了他们对我们技术的采用。自2022年推出以来,我们观察到市场从传统的随机整合技术到基于转座子系统的快速转变,许多制药公司和CDMO已经采用CHOSOURCE TnT转座子技术来开发和制造生物治疗药物。”
三优生物CEO郎国竣博士表示:“很高兴能再一次和瑞孚迪展开战略合作。此前三优生物引入了两项瑞孚迪关于GS敲除CHO K1细胞株的商业化授权,在帮助三优生物的合作伙伴创新生物药的研发中发挥了重要作用。此次双方就TnT转座系统再次展开深度合作,这一先进的平台将进一步提升三优生物生产用细胞株开发平台的核心竞争力,加速新技术在创新生物药研发中心的应用进程。三优生物将继续携同优质合作伙伴,打造国际领先的研发及前沿转化平台,协同各方共建健康社会。”
CHOSOURCE™ TnT转座子技术与CHOSOURCE™ GS KO细胞系结合可产生许多优势。它通过确保细胞池选择期间的快速恢复时间并保持池和克隆之间的高一致性,显著地简化了开发时间。这种高水平的可重复性减少了对多个细胞池和/或克隆进行广泛筛选的需要,从而简化了细胞系开发过程。TnT转座酶以mRNA的形式传递,为宿主细胞的遗传修饰提供了一种安全可靠的方法,消除了与宿主基因组整合的风险,防止了基因组的改变或不稳定。CHOSOURCE TnT转座子技术具有加速临床前和潜在临床开发的潜力,为新的开发范例铺平了道路。
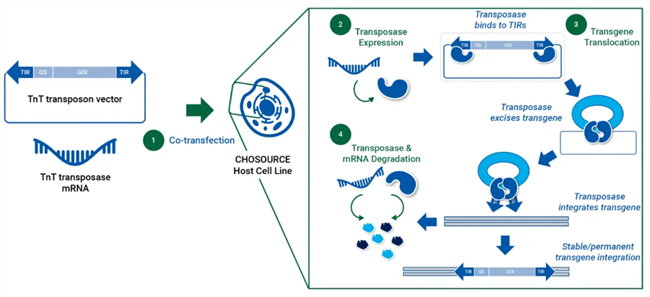
▲ CHOSOURCE™ TnT转座技术作用机制
关于瑞孚迪
在瑞孚迪(Revvity),我们将“不可能”视为灵感,将“做不到”视为原动力。瑞孚迪提供健康科学解决方案、前沿技术和专业服务,业务涵盖科研探索、开发、诊断、治疗的端到端全流程。依托在转化多组学技术、生物标志物鉴定、成像、疾病的预测、筛查、检测与诊断、信息学等领域的多年深耕,瑞孚迪正以科技之能,突破人类潜能的边界。
2023年瑞孚迪的营业额超过27亿美元,全球拥有11,000多名员工,为制药和生物技术企业、诊断实验室、科研机构和政府机构等客户提供多样化服务。公司是标准普尔500指数的成员,客户遍及全球190多个国家和地区。
关于三优生物
三优生物成立于2015年,是一家国际领先的专注于创新生物药研发和服务的高新技术企业;公司致力于实现“让天下没有难做的创新生物药”的使命;公司建立了“差异化CRO、整合型CDO、协同型CPO、特色CRS”于一体的4C综合业务体系。
公司建立了设施设备先进齐全的创新生物药一体化研发实验室;公司发展起了一支以硕士和博士为主的专业团队;公司打造了居于行业领军水平的“超万亿、一体化、智能化”三大创新药研发技术平台;公司建立了以十万亿噬菌体展示分子库为代表的,涵盖原材料制备、分子发现、分子优化、体内外药效、细胞株构建、上下游工艺、临床前研发及产业化开发等的50多个技术子平台。
公司的业务网络已扩展至中美欧等世界各地,公司在波士顿、费城、圣地亚哥和伦敦等地设有业务网点;公司已和全球1000多家制药公司、药物研发机构、诊断试剂产品公司建立了友好的业务合作关系。公司已获得国家高新技术企业、专精特新、ISO9001质量管理体系、GB/T知识产权管理体系等认证。
上海之声版权及免责声明:
1、凡本网注明 “来源:***(非上海之声)” 的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
2、如因作品内容、版权和其它问题需要同本网联系的,请在30日内进行。